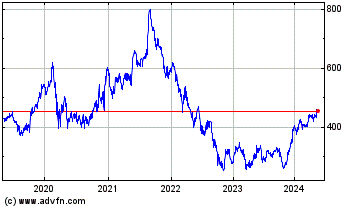
Genuit (LSE:GEN)
Historical Stock Chart
From Dec 2019 to Dec 2024